Зрение является одним из важнейших органов чувств человека, и его утрата часто приводит к значительному снижению качества жизни. Дегенеративные заболевания сетчатки, такие как ретинит пигментоза и возрастная макулярная дегенерация, поражают миллионы людей в мире. Главной трудностью в лечении этих болезней становится неспособность клеток центральной нервной системы, в том числе сетчатки, восстанавливать поврежденные нейроны. Однако последние исследования открывают новые горизонты, показывая, что ключевую роль в регенерации сетчатки могут играть Muller-глиальные клетки. Эти уникальные клетки имеют потенциал к перезарождению рецепторов и других нейронов сетчатки, если удастся преодолеть природные ограничения их регенеративных возможностей.
Müller-глия представляют собой разновидность сиалоцитов, которые расположены по всей толщине сетчатки и выполняют функцию опорных и питающих клеток для нейронов. В отличие от нейронов, они способны к некоторому делению и способны в определенных условиях трансформироваться в клетки-предшественники нейронов. В холоднокровных животных, например, у рыб и амфибий, именно Müller-глия обеспечивают регенерацию поврежденной сетчатки, превращаясь в ретинальные прогениторные клетки, которые затем дифференцируются в различные типы ретинальных нейронов, восстанавливая утраченные функции зрения. В млекопитающих этот процесс значительно ограничен, что объясняется как отсутствием определённых активирующих факторов, так и наличием подавляющих регенерацию элементов. Одним из ключевых факторов, мешающих регенерации сетчатки через Müller-глию у млекопитающих, является белок Prox1 - трансрипционный фактор из семейства homeobox, играющий значимую роль в развитии и дифференцировке клеток.
Ученые выявили, что Prox1 накапливается в Müller-глиальных клетках сетчатки при их повреждениях, но при этом он не синтезируется ими самостоятельно. Prox1 проникает в Müller-глию из соседних ретинальных нейронов путем межклеточного переноса, что является уникальной чертой для белков с homeobox-доменом. Именно присутствие этого белка в Müller-глиальных клетках подавляет их способность к переходу в состояние клеток-предшественников, препятствуя запуску процесса регенерации. Разобравшись с источником и механизмом действия Prox1, исследователи разработали стратегию по блокировке его межклеточного переноса. Для этого был создан специализированный анти-Prox1 антитело в виде односцепочной фрагментной части (scFv), которая связывает Prox1 в межклеточном пространстве и препятствует его попаданию в Müller-глиальные клетки.
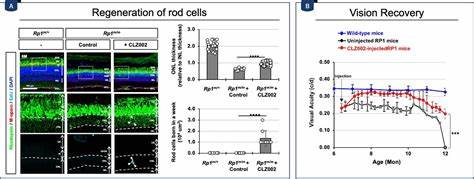
Генетическая доставка этого антитела с помощью аденоассоциированных вирусов (AAV) позволила эффективно снизить уровень Prox1 в Müller-глии на моделях поврежденной сетчатки у мышей. Результаты были впечатляющими: Müller-глия обрели способность к пролиферации и превращению в ретинальные прогениторные клетки, что ранее наблюдалось только у холоднокровных животных. Дополнительные эксперименты подтверждали положительный эффект данной терапии: в моделях ретинита пигментоза у мышей после введения анти-Prox1 антитела появлялись новые клетки-фоторецепторы, причем они были функционально активными. Это подтверждалось и результатами электрофизиологических тестов, показывающих улучшение параметров зрительной активности. Более того, визуальная острота подопытных животных существенно улучшалась после лечения.
Однако важно отметить, что успешность терапии напрямую зависела от раннего начала лечения, до значительных дегенеративных изменений в сетчатке, и её эффекты носили временный характер, что требует дальнейших исследований для продления и устойчивости лечения. Интересной особенностью является отличие реакции различных моделей сетчатых повреждений: у рыб, обладающих врожденным потенциалом к регенерации, уровень Prox1 в Müller-глии после травмы остается низким, позволяя процессу регенерации проходить естественным образом. У млекопитающих же, напротив, наблюдается повышение Prox1, что свидетельствует о существенном ретроспективном подавлении регенеративного потенциала. Этот факт подчеркивает критическую роль экзогенного Prox1 в торможении преобразования Müller-глии в клетки-предшественники. На молекулярном уровне Prox1 влияет на экспрессию генов, регулирующих клеточный цикл и прогениторные состояния.
При снижении экспрессии Prox1 активируются проолиферативные гены, такие как Cyclin D1 (Ccnd1), Notch1 и Hes1, что способствует переходу Müller-глии в состояние клеток с высоким регенеративным потенциалом. Одновременно подавляется экспрессия факторов, ингибирующих пролиферацию. Следует подчеркнуть, что классический регулятор нейрогенеза Ascl1 не восстанавливается, что указывает на альтернативные пути перезапуска регенеративных механизмов, новые для млекопитающих. Терапия, основанная на блокировке Prox1, открывает дорогу для разработки новых подходов к лечению дегенеративных заболеваний сетчатки, в частности тех, которые сопровождаются потерей фоторецепторов. Возможность перезапуска врожденного потенциала к регенерации Müller-глии дает надежду восстановить зрение без необходимости пересадки клеток или применения сложных генной инженерии, используя собственные резервы сетчатки.
Это особенно актуально учитывая растущую распространенность дегенеративных глазных патологий вследствие старения населения. Понимание процессов передачи Prox1 между клетками также позволяет задуматься о более широкой роли межклеточной сигнализации в регуляции нейронального обновления и поддержки тканевого гомеостаза. Принцип переноса трансрипционных факторов может находить применение и в других областях нейробиологии и регенеративной медицины. Несмотря на значительные успехи, перед непосредственным клиническим применением данной методики стоит преодолеть ряд вызовов. На сегодняшний день остается нерешенным вопрос оптимальной долгосрочности выражения терапевтических антител и возможности сочетания блокирования Prox1 с другими модуляторами врожденных путей регенерации, такими как Notch, Wnt или Hippo сигнальные каскады.
Также необходимо учитывать, что Müller-глия участвуют в многих других важнейших функциях сетчатки, и длительное вмешательство может иметь непредсказуемые последствия. Дальнейшие доклинические и клинические исследования помогут определить безопасность, эффективность и рамки применения этой перспективной терапии. Таким образом, открытие роли Prox1 как барьера для регенеративного потенциала Müller-глии и успешное экспериментальное блокирование его межклеточного переноса позволили возродить способность регенерации сетчатки у млекопитающих. Этот подход представляет фундаментальный прорыв в офтальмологии и регенеративной медицине и обещает значительные улучшения для пациентов с тяжелыми дегенеративными заболеваниями зрения, для которых до сих пор не было эффективных методов лечения. .

![Erlang/OTP Matters in 2025 [video]](/images/5A42799C-880A-4E32-BFFC-85A6A70014D6)