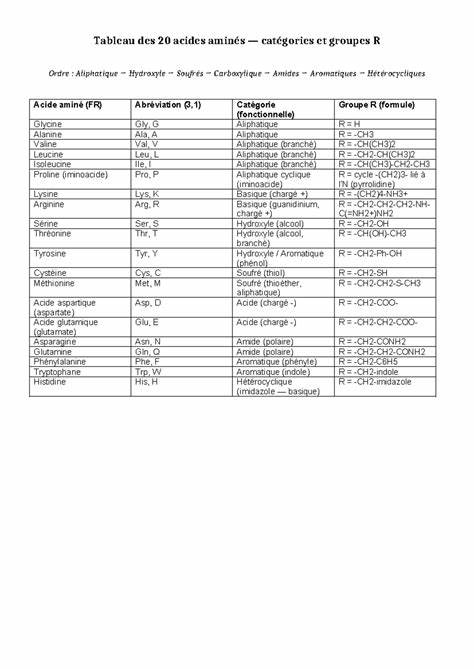
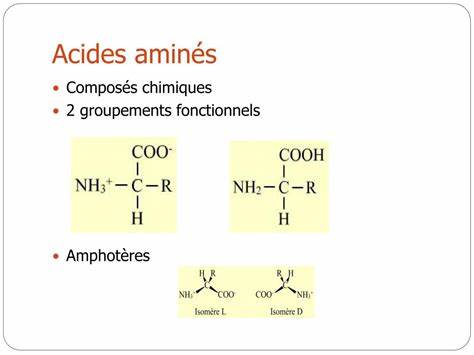
Аминокислоты являются фундаментальными строительными блоками белков, которые отвечают за множество биологических функций в клетках живых организмов. Понимание структуры и классификации аминокислот помогает глубже осознать механизмы работы белков и их влияние на здоровье и жизнедеятельность организма. В нашем обзоре мы рассмотрим двадцать основных аминокислот, их функциональные группы и категории, классифицируемые по химическим свойствам боковых цепей. Аминокислоты можно классифицировать на основе природы их боковых цепей, которые называются радикалами или группами R. Основные категории включают алифатические, гидроксильные, серосодержащие, кислотные, амидные, ароматические и гетероциклические аминокислоты.
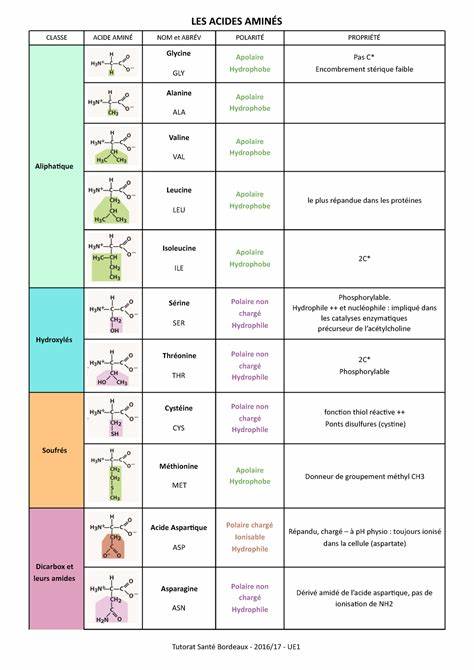
Каждая категория имеет свои уникальные характеристики и биохимическое значение. Алифатические аминокислоты характеризуются неполярными, гидрофобными боковыми цепями, обычно содержащими углеводородные группы без ароматических колец. В эту категорию входят глицин, аланин, валин, лейцин, изолейцин и пролин. Глицин выделяется своей минимальной боковой цепью - всего один атом водорода, что делает его самым простым аминокислотным остатком. Пролин отличается уникальной циклической структурой, где боковая цепь образует цикл с аминной группой, что влияет на структуру белков, особенно на формирование вторичных структур, таких как спирали и петли.
Гидроксильные аминокислоты, такие как серин, треонин и тирозин, содержат гидроксильную группу (-OH) в боковой цепи, что придает им полярность и возможность участвовать в водородных связях. Эти аминокислоты часто становятся участниками ферментативных реакций и могут подвергаться фосфорилированию, что регулирует активность белков. К серосодержащим аминокислотам относятся цистеин и метионин. Цистеин имеет в боковой цепи тиольную группу (-SH), которая способна формировать дисульфидные связи, важные для стабилизации третичной и четвертичной структуры белков. Метионин обладает тиоэфирной группой и часто выступает в качестве стартового аминокислотного остатка при биосинтезе белков.
Аминокислоты с кислотными боковыми цепями, такие как аспартат и глутамат, несут отрицательный заряд при физиологическом значении pH, что делает их важными для кислотно-щелочного баланса и взаимодействий с другими молекулами внутри клетки. Они могут участвовать в трансферазных реакциях и играют роль в передаче нервных импульсов. Амидные аминокислоты - аспарагин и глутамин - отличаются наличием амидной группы в боковой цепи, что придает им полярность и способствует участию в гидрофильных взаимодействиях. Они часто вовлечены в транспорт аммиака и функцию азотистого обмена. Ароматические аминокислоты включают фенилаланин, тирозин и триптофан.
Их боковые цепи содержат ароматические кольца, обеспечивающие специфические поглощательные свойства и участвуют в стабилизации белковых структур через π-π взаимодействия. Триптофан и тирозин также играют роль прекурсоров различных биологически активных молекул, таких как серотонин и допамин. Гетероциклические аминокислоты - это гистидин, обладающий уникальной имидозольной группой, способной связывать протоны и играть роль буфера в белках. Его базовые свойства делают его незаменимым в активных центрах многих ферментов. Понимание химической природы боковых цепей аминокислот имеет важное значение для биохимиков, молекулярных биологов и медиков.
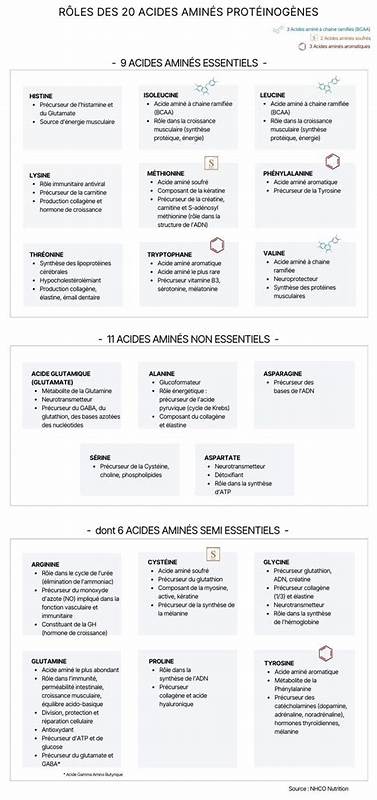
Эти знания влияют на разработку лекарств, изучение механизма заболеваний и биотехнологические приложения. Кроме того, классификация аминокислот облегчает понимание структуры и функции белков, а также их взаимодействий в клеточных системах. Изучение двадцати аминокислот и их классификации открывает дверь к пониманию множества биохимических процессов. Их разнообразие и специфические химические свойства обеспечивают сложность и функциональность живых организмов на молекулярном уровне. Знание данных аминокислот, их структуры и категорий является краеугольным камнем современного биологического и медицинского образования, а также фундаментом для исследований в области молекулярной биологии и биохимии.
.