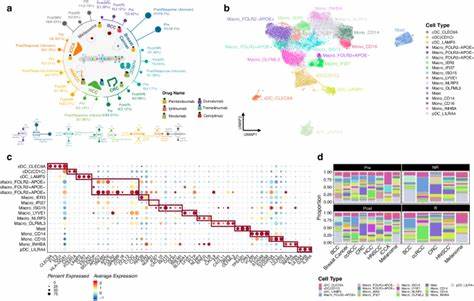
Понимание микросреды опухоли (Tumor Microenvironment, TME) является одним из ключевых вызовов современной онкологии. ТМЕ представляет собой сложную экосистему, включающую разнообразные клетки, в том числе иммунные и стромальные, а также многочисленные молекулярные процессы, которые влияют на развитие, прогрессирование опухоли и ее реакцию на лечение. На сегодняшний день исследование ТМЕ становится неотъемлемой частью комплексного анализа при диагностики и терапии онкологических заболеваний. Инновационный подход, сочетающий девять различных методов деконволюции, позволил впервые в рамках обширного пан-карцинного исследования выявить состав и взаимодействия 79 типов клеток микроокружения в более чем 10 тысячах опухолевых образцов, охватывая 33 типа рака. Этот метод интегрированной оценки обеспечивает более точное и комплексное представление о динамике микросреды в сравнении с традиционными однотехническими подходами.
Одной из ключевых особенностей данного исследования стала разработка интегрированных оценок (iScores), которые объединяют результаты девяти методов деконволюции для каждого клеточного типа. Такой подход минимизирует систематические ошибки отдельных методов и расширяет диапазон распознаваемых клеточных компонентов, включая не только классические иммунные клетки, но также разнообразные стромальные, прогениторные и стволовые клетки, а также механизмы, связанные с функцией ТМЕ, такие как гипоксия и ангиогенез. Верификация точности iScores осуществлялась с использованием различных независимых источников, включая данные анализа ДНК-метилирования и показатели клинической гистопатологии, что подтвердило их высокую корреляцию с известными биологическими маркерами и реальным содержанием клеток в опухоли. Это дает важное преимущество для широкого применения данного подхода на имеющихся больших массивах данных RNA-seq. Анализ распределения лейкоцитарных индексов по разным типам рака показал значительные вариации, охватывая от высоких уровней иммунной инфильтрации в гематологических опухолях до низких значений в опухолях иммунопривилегированных органов.
Эти вариации имеют выраженную клиническую значимость — для многих когорт повышение уровня иммунных клеток ассоциировалось с улучшением прогнозов, снижением риска прогрессирования и увеличением общей выживаемости. Исключением стали опухоли головного мозга, где инфильтрация лейкоцитов могла указывать на индуцирование иммуносупрессивных механизмов. Глубокий скрининг отдельных подтипов иммунных клеток выявил их разностороннее влияние на исходы пациентов. Например, цитотоксические CD8+ T-клетки и естественные киллеры в большинстве случаев коррелировали с благоприятным прогнозом. В то же время макрофаги M2, обладающие противовоспалительными свойствами, чаще были связаны с неблагоприятным течением, особенно в глиобластомах.
Регуляторные T-клетки (Tregs), будучи иммунными супрессорами, отрицательно влияли на прогноз, особенно при почечно-клеточном раке. Такие этиологические зависимости не только углубляют понимание иммунной биологии опухолей, но и могут служить основой для разработки новых иммунотерапевтических стратегий, направленных на конкретные клеточные субпопуляции. Не менее значимым оказалось исследование стромальных компонентов микроокружения. Стромальные клетки, такие как фибробласты, эндотелиальные клетки и перицисты, играют роль в формировании архитектуры опухоли, поддержании ангиогенеза и модификации иммунного ответа. Анализ показал, что общие показатели стромы обычно не коррелируют напрямую с выживаемостью, однако отдельные подтипы стромальных клеток демонстрировали положительное или отрицательное влияние на риск прогрессирования в зависимости от типа рака.
Важным аспектом являются взаимодействия между иммунными и стромальными клетками. Например, сочетание уровней CD8+ T-клеток и эндотелиальных клеток или фибробластов значительно влияет на прогноз, подтверждая сложную регуляцию ТМЕ через межклеточные связи. Систематическая классификация опухолей на основе комплексных профилей ТМЕ выявила 41 уникальный кластер, отражающий характерные особенности каждого из 33 типов рака. Благодаря такому картографированию стало возможным выйти за рамки традиционных гистологических классификаций и выявить группы пациентов с различным иммунным статусом и риском прогрессирования даже внутри одного подтипа опухоли. Например, в раке мочевого пузыря обнаружены подгруппы с высоким и низким иммунным статусом, которые демонстрируют значительные различия по мутационной нагрузке и выживаемости.
Аналогичным образом у меланом обнаружены иммунно-богатые и иммунно-бедные кластеры, различающиеся по паттернам мутаций, особенно в отношении «горячих» мутаций RAS. Это позволяет предположить, что иммунно-богатые опухоли у таких пациентов могут лучше откликаться на современные иммунотерапии, ориентированные на блокаду иммунных контрольных точек. Генетический фон опухоли также тесно связан с составом микроокружения. Анализ 299 драйверных генов выявил множество мутантных генов с выраженной ассоциацией с иммунно-стромальными портретами опухолей. Отмечены как положительные связи, когда определённые мутации связаны с повышенной иммунной инфильтрацией, так и отрицательные — указывающие на механизмы иммунного исключения.
В частности, мутации в генах CASP8, связанных с апоптозом и иммунным ответом, ассоциировались с увеличением разнообразных типов иммунных клеток, тогда как мутации в NRAS коррелировали с их снижением. Для отдельных опухолей выявлены специфические варианты мутаций, влияющие на клеточный состав ТМЕ, что расширяет понимание молекулярных основ иммунного микросреды и механизма опухолевой резистентности. Также исследование затронуло вопрос значимости мутационной нагрузки опухоли (Tumor Mutation Burden, TMB) для прогнозирования иммунной инфильтрации. Несмотря на общие ожидания, обнаружена лишь слабая пан-карцинная корреляция между TMB и показателями иммунной клеточной инфильтрации, с вариабельностью в разных типах рака. Это свидетельствует о том, что TMB не всегда является независимым и достоверным предиктором ответа на иммунотерапию, что требует комплексного анализа с включением других биологических и клинических маркеров.
В совокупности, результаты исследования пан-карцинного анализа иммунного и стромального состава ТМЕ через интеграцию нескольких методов деконволюции открывают новые горизонты для фундаментальной и прикладной онкологии. Помимо улучшения диагностики и прогноза, накопленные знания создают предпосылки для персонализированного подбора иммунотерапии и разработки таргетных препаратов, направленных на модуляцию конкретных клеточных взаимодействий в микросреде. Дальнейшие перспективы включают внедрение этих интегрированных подходов в клинические протоколы, расширение анализов с применением пространственных и одноклеточных технологий, а также глубокое изучение функциональных последствий обнаруженных мутаций в контексте иммунного ответа и стромальной поддержки опухоли. Это стратегически важный шаг к созданию эффективных мультидисциплинарных лечебных схем, максимально учитывающих сложность и динамичность опухолевой биологии.