Дегенеративные заболевания сетчатки являются одной из основных причин потери зрения во всем мире. С возрастом или вследствие различных заболеваний, таких как ретинит пигментоза и глаукома, клетки сетчатки, ответственные за восприятие света и передачу визуальной информации в мозг, начинают постепенно разрушаться. Традиционные методы лечения чаще всего направлены на задержку прогрессирования болезни, но не обладают способностью восстанавливать утраченные клетки и восстанавливать зрение. В связи с этим все больше внимания уделяется изучению механизмов регенерации сетчатки и поиску способов активировать эти процессы у человека. Одним из ключевых игроков в этом направлении являются глиальные клетки Мюллера (Мюллеровские глиальные клетки, MG) - специализированные клетки, обеспечивающие структурную и метаболическую поддержку нейронов сетчатки.
В отличие от млекопитающих, у холоднокровных позвоночных, таких как рыбы и амфибии, MG обладают естественным потенциалом к регенерации и способны преобразовываться в ретинальные прогениторные клетки, которые затем восстанавливают поврежденные нейроны. Однако у млекопитающих эта способность отсутствует или выражена крайне слабо, что затрудняет лечение дегенеративных процессов в человеческом глазу. Современные исследования позволили выявить один из главных барьеров, сдерживающих регенерацию сетчатки у млекопитающих - транслокацию транскрипционного фактора Prox1 в глиальные клетки Мюллера из соседних нейронов сетчатки. Prox1 - это эволюционно консервативный фактор, который обеспечивает торможение пролиферации нейрональных стволовых и прогениторных клеток, стимулируя их дифференцификацию. В норме у глиальных клеток Мюллера мышей Prox1 не экспрессируется на уровне мРНК, однако при повреждениях сетчатки происходит накопление белка Prox1 в этих клетках.
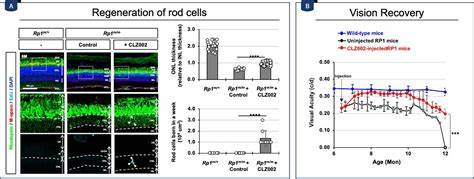
Интересно, что данное накопление не связано с активацией собственного гена Prox1 в МГ, а результатируется межклеточным переносом белка из близлежащих нейронов, в первую очередь биполярных клеток. Этот феномен подтверждается рядом экспериментов, в том числе с использованием генетических моделей, в которых удаление Prox1 из биполярных клеток снижало его уровень в глиальных клетках Мюллера, что приводило к активации пролиферации последних и их частичной перепрограммировке в ретинальные прогениторные клетки. Подтверждением значимости этого механизма служит то, что при введении во внутренний слой сетчатки антии Prox1 антитела, способного связывать и удерживать extracellular Prox1, удается снизить уровень этого фактора в Мюллеровских глиальных клетках. Такое вмешательство ведет к восстановлению пролиферативного потенциала и способствует генерации новых нейронов сетчатки, в том числе фоторецепторов и биполярных клеток. Экспериментальные модели ретинальных повреждений у мышей, такие как вызванные химическими агентами или генетические модели ретинита пигментоза, продемонстрировали, что подавление межклеточного переноса Prox1 существенно задерживает прогрессирование дегенерации и восстанавливает функции зрения, по крайней мере на ранних стадиях патологии.
Многие механизмы, вовлеченные в регенерацию сетчатки у холоднокровных, включают сложный каскад сигналов, среди которых сигнализация Wnt, Notch, Sonic Hedgehog, а также факторы роста, такие как Fgf и Hbegf. Все они обеспечивают последовательное переходы глиальных клеток в активное состояние, вход в клеточный цикл и последующую дифференциацию в нейроны. Однако у млекопитающих активация этих путей ограничена или слаба. Ключевым препятствием здесь выступает высокий уровень подавляющего фактора Prox1, который тормозит деление и переключение клеточного состояния МГ. Важно отметить, что сдерживание Prox1 способствует развитию ретинальных прогениторных клеток с экспрессией таких маркеров, как Gadd45a, Hbegf, Notch1, Hes1 и ряда циклинов, что создает среду для пролиферации и восстановления нейрональных элементов.
Кроме того, работаируемые исследования выявили, что в глазах пациентов с ретинальной дегенерацией и у соответствующих моделей на животных Prox1 накапливается в МГ, что подчеркивает клиническую значимость данного механизма. Помимо клеточных и молекулярных аспектов, в контексте регенерации сетчатки стоит упомянуть и эпигенетическую регуляцию, которая играет важную роль в перепрограммировании глиальных клеток. В частности, помимо снижения Prox1, для полного входа МГ в состояние RPC необходима активация экспрессии таких факторов, как Ascl1, и модификации хроматина, включая ацетилирование гистонов и деметилирование ДНК. Комплексное воздействие на эти процессы может значительно усилить регенеративный потенциал. В качестве перспективного терапевтического инструмента в последнее время разрабатываются вирусные векторы, доставляющие антитела или другие модуляторы, направленные на снижение активности Prox1 в МГ.
Введение аденоассоциированных вирусов (AAV) с кодирующими анти-Prox1 белками в ранних стадиях дегенерации способствует снижению накопления Prox1, стимулированию пролиферации МГ и увеличению числа вновь образованных фоторецепторов, что восстанавливает зрительные функции у животных моделей. Несмотря на значительный прогресс, который продемонстрировал потенциал блокирования Prox1 для восстановления сетчатки, важным остается вопрос продолжительности и полноты полученного эффекта. Наблюдения показывают, что полученный регенеративный ответ пока неоднороден и требует дополнительной поддержки, например, с использованием других факторов роста или эпигенетических модификаторов, для устойчивого решения проблемы. В совокупности, выявление межклеточного переноса транскрипционного фактора Prox1 как ключевого тормозящего механизма регенерации в сетчатке открывает новые горизонты в биомедицинских исследованиях и разработке инновационных методов лечения дегенеративных заболеваний глаза. Ожидается, что дальнейшее изучение молекулярных путей и улучшение технологий доставки терапевтических агентов позволит реализовать прорыв в восстановлении зрения для миллионов пациентов по всему миру.
.