В последние годы биотехнологии сделали значительный скачок в создании и модификации геномов организмов. Одним из наиболее значимых прорывов стало умение собирать крупномасштабные фрагменты синтетической ДНК — в масштабах мегабаз, соответствующих длине миллионов пар оснований, — и внедрять их в живые клетки. Этот подход позволяет подробно исследовать механизмы регуляции генов, эпигенетические изменения и процессы развития на качественно новом уровне. Наиболее впечатляющим достижением стал успешный синтез и доставка мегабазной, синтетической человеческой ДНК непосредственно в ранние эмбрионы мышей. Данный процесс открывает уникальные возможности для понимания фундаментальных принципов эпигенетики и транскрипционной регуляции.
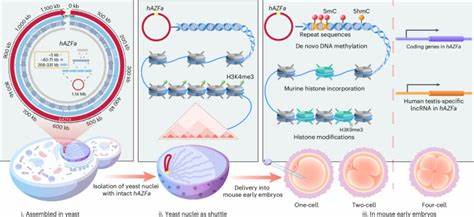
Область изучения таких массивных синтетических ДНК сейчас называется методикой SynNICE — это комплексный подход, включающий химическую сборку крупномасштабных фрагментов ДНК в дрожжах с последующей изоляцией ядер, содержащих эти ДНК, и их непосредственной эндоцитом в мышиные эмбриональные клетки. Главным примером использования данной технологии служит синтез 1.14 мегабазного фрагмента человеческой Y-хромосомы, известного как локус AZFa. Данный участок включён в геном и играет ключевую роль в мужской фертильности, и его изучение при помощи моделей обусловлено важностью разбора механизмов заболеваний, связанных с его микроделециями. Ключевой вызов, который стоял перед учёными — собрать такой гигантский и при этом богатый повторяющимися элементами участок ДНК с высокой точностью.
Традиционные методы, основанные на бактериях, встречали ограничение на стабильное хранение цепей длинной более 500 килобаз. Решением стала многократная сборка коротких синтезированных фрагментов в дрожжевых клетках с применением комбинаторного рекомбинационного подхода. Такой процесс позволил не только добиться точного соединения, но и сохранить стабильность и функциональную целостность всей конструкции. После сборки ДНК внутри дрожжей, разработчики применили инновационную методику изоляции целых ядер дрожжей — NICE (Nucleus Isolation for Chromosomes Extraction), которая крайне бережно сохраняет структуру и минимизирует деградацию ДНК. Белковые комплексы и хроматиновая упаковка сохраняются, что создаёт максимально приближённые к природным условиям для дальнейшего изучения синтетической последовательности.
Доставка изолированных ядер с мегабазной ДНК была осуществлена в мышиные ооциты посредством микроинъекций, что является уникальной и весьма сложной методологией. Вместо прямой инъекции «голой» ДНК метод SynNICE использует защитную натуральную оболочку ядра, позволяющую доставлению проходить с минимальным повреждением сложных фрагментов. В уже ранние стадии развития эмбрионов была обнаружена спонтанная замена дрожжевых гистонов на мышиные, а также активное установление т.н. де нуво метилирования ДНК – важнейшего эпигенетического маркера, отсутствующего в дрожжевой ДНК.
Особенно интересно, что этот процесс был концентрирован на повторяющихся участках синтетического локуса, и происходил без типичного упрочнения метилирования с помощью гистонового модификатора H3K9me3, что традиционно наблюдается у природных хромосом. Анализ экспрессии генных элементов, встроенных в локус AZFa, показал, что транскрипционная активность начинается с четырёхклеточной стадии эмбриона, причём она напрямую регулируется динамикой метилирования ДНК. Эти открытия указывают на то, что моментальная инициация эпигенетических изменений и активация генов синтетической ДНК точно воспроизводят процессы, присущие естественным хромосомам, но при этом открывают новые аспекты взаимодействия между ДНК и клеточным окружением. Кроме фундаментальной научной ценности, технология SynNICE и результаты синтеза многомегабазных фрагментов человеческой ДНК имеют большие прикладные перспективы. Возможность создавать и внедрять синтетические человеческие локусы даёт шанс моделировать различные заболевания человека на животной модели с высоким уровнем детализации, лучше понимать пути лечения и разрабатывать персонализированные терапевтические стратегии.
Кроме того, эти методы являются важным шагом к созданию полностью искусственных хромосом и, в будущем, могут стать базисом для синтетического конструирования геномов человека и других млекопитающих. В плане технических новаций стоит отметить, что дружба между методами генной химии, рекомбинационного клонирования и точной микроманипуляции объединилась в единую платформу, способную решать задачи, которые ещё недавно казались нереализуемыми. Всё это расширяет горизонты биологии развития, эволюционной генетики и медицинских исследований в сторону системного, пространственно-временного анализа процессов регуляции генов на мегабазном уровне. Стоит также подчеркнуть, что указанная технология помогает избавиться от наследованных эпигенетических меток, которые с трудом удаляются при изучении естественных геномных участков. Таким образом, появляется возможность анализировать закладку метилирования и других модификаций «с нуля» при внедрении тимпанированных синтетических ДНК.
Будущее исследований в данной области связано с совершенствованием методов конструирования и доставки ещё более крупных и сложных фрагментов генома, изучением интеграции этих искусственных секвенций в хроматиновую структуру, а также раскрытием биологических последствий и потенциала для биомедицинских приложений. В итоге, метод SynNICE и его успешное применение демонстрируют, что научное сообщество приблизилось к полноценному «переписыванию» геномов в млекопитающих, используя для этого полностью синтетические участки ДНК, что радикально расширяет возможности геномной инженерии на благо человечества.