Одной из главных проблем при лечении рака традиционными методами химиотерапии является высокая токсичность лекарственных препаратов для всего организма. Часто препараты воздействуют не только на опухолевые клетки, но и на здоровые ткани, что приводит к тяжелым побочным эффектам и снижает качество жизни пациентов. Ученые всего мира давно ищут способы избирательной доставки лекарств именно в раковые клетки, чтобы минимизировать вред и повысить эффективность лечения. В этом контексте исследователи из Массачусетского технологического института (MIT) сделали значительный прорыв, разработав инновационную технологию на основе наночастиц, напоминающих по форме щетку - так называемые "щеточные" частицы. Эти частицы способны доставлять огромные дозы химиотерапевтических средств прямо в опухолевые клетки, используя для навигации антитела, направленные на определенные опухолевые белки.
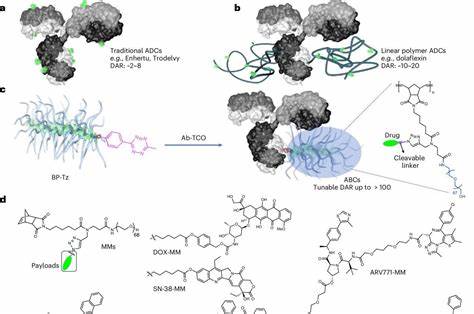
Такая система обещает изменить ландшафт онкологической терапии, позволяя применять новые комбинации лекарств и значительно снижать осложнения терапии. Каркас "щеточных" частиц представляет собой полимерную структуру с многочисленными ответвлениями, на которых закреплено большое количество молекул про-лекарств - неактивных форм токсичного вещества, активирующихся непосредственно в очаге опухоли. С помощью уникального метода "click chemistry" ученые смогли прикрепить к одному антителу сразу несколько таких полимерных нитей, что позволило превзойти ограничение традиционных антитело-лекарственных конъюгатов (Antibody-Drug Conjugates, ADCs), которые могут нести всего несколько молекул лекарства. В результате "щеточные" частицы (ABC - Antibody-Bottlebrush Conjugates) становятся мощным транспортным средством, способным нести сотни молекул химиотерапевтических препаратов. Традиционные ADC часто ограничены в выборе препаратов из-за ограниченной грузоподъемности.
Они обычно используют очень мощные препараты, разрушающие ДНК или нарушающие процесс деления клеток. Однако благодаря новой технологии можно использовать более широкий спектр лекарств, включая менее токсичные, но всё же эффективные препараты, такие как доксорубицин и паклитаксел. Это не только расширяет арсенал лекарств, но и дает возможность создавать индивидуальные комбинации препаратов, адаптированные под конкретный тип рака и его биологические особенности. Важной особенностью технологии является наличие в частицах соединителей, разрывающихся в условиях опухолевого микросреды. Это обеспечивает постцелевая активация лекарств: часть соединителей разрывается сразу после достижения опухоли, воздействуя на окружающие раковые клетки даже без попадания внутрь них, а часть частиц проникнет внутрь клетки на основе физиологической активности, высвобождая лекарство уже внутриклеточно.
Такая двухступенчатая система способствует максимальному поражению опухоли при минимальном воздействии на здоровые ткани. В ходе исследований на мышиных моделях рака молочной и яичниковой железы показано, что терапия с помощью "щеточных" частиц с антителами против HER2 и MUC1 способна полностью уничтожать опухоли. Эффективность лечения превосходит как применение свободных лекарств, так и традиционных антиген-лекарственных конъюгатов, включая одобренные FDA препараты T-DXd и TDM-1. При этом используемые дозы в десятки раз меньше чем при обычной терапии, что значительно улучшает переносимость лечения и снижает риск осложнений. Перспективы дальнейшего развития технологии впечатляют.
В планах ученых - создание частиц с несколькими одновременно загруженными препаратами, позволяющими реализовать комбинированную терапию с препаратами, работающими по разным механизмам. В частности, рассматривается возможность совместного использования иммуномодулирующих средств, таких как активаторы STING, что позволит не только напрямую уничтожать опухолевые клетки, но и усиливать противоопухолевый иммунитет организма. Кроме того, технология не ограничивается лишь двумя тестируемыми антителами. Свыше ста одобренных к медицинскому применению антител могут быть адаптированы для занятий "щеточных" частиц, расширяя типы раковых заболеваний, поддающихся таргетной терапии. В числе перспективных целей для антител числится EGFR - рецептор эпидермального фактора роста, присутствующий во многих видах опухолей.
Основной научный труд, освещающий эту разработку, опубликован в высокорейтинговом журнале Nature Biotechnology, подчеркивая значимость открытия для биомедицины и онкологии. Финансирование исследования осуществлялось при поддержке Национального института здоровья США, Людвиг-центра MIT и специализированной программы Koch Institute Frontier Research. Таким образом, "щеточные" частицы с антителами становятся новым мощным инструментом в борьбе с раком, обеспечивая целевую доставку больших доз химиопрепаратов при минимальных побочных эффектах. Эта технология не только повышает шансы на успешное лечение многих типов рака, но и открывает путь к созданию персонализированных лекарственных конструкций с возможностью контроля дозировки и сочетания различных препаратов. В перспективе они могут стать ключевой частью комплексных онкологических протоколов, существенно улучшая прогноз и качество жизни пациентов.
Новый подход к таргетной терапии основан на интеграции химии, биотехнологий и нанонауки, подчеркивая важность междисциплинарных исследований в борьбе с тяжелыми заболеваниями. Результаты работы команды MIT вселяют оптимизм в подход к лечению злокачественных новообразований и формируют основу для будущих инноваций в медицине, которые позволят максимально эффективно и безопасно воздействовать на опухоли, сохраняя при этом здоровье организма в целом. .