Боковой амиотрофический склероз, широко известный как БАС, – одно из самых разрушительных и загадочных нейродегенеративных заболеваний нашего времени. Поражая двигательные нейроны в головном и спинном мозге, болезнь постепенно лишает пациентов способности управлять мышцами, что приводит к утрате речи, движения и, в конечном итоге, способности дышать самостоятельно. На сегодняшний день эффективных методов лечения, способных замедлить или остановить прогрессирование заболевания, к большому сожалению, не существует. Однако недавние научные достижения, сделанные исследователями из Института Аллена, внушают надежду и открывают совершенно новые горизонты в борьбе с этим коварным недугом. Ключевой проблемой в изучении и лечении БАС всегда было то, что двигательные нейроны, являющиеся главной мишенью заболевания, крайне сложно было точно определить и воздействовать на них с помощью существующих генетических инструментов.
Без возможности выделить и анализировать именно те клетки, которые погибают при БАС, разработка лекарств оказывалась похожей на поиск иголки в стоге сена. Новая методика, предоставляющая возможность «навести GPS» непосредственно на эти нейроны, фундаментально меняет ситуацию. Исследователи разработали инновационный генетический инструмент, который позволяет выявлять и маркировать двигательные нейроны с исключительной точностью. Этот прорыв произошел благодаря глубокому анализу молекулярного состава каждого отдельного типа клеток в спинном мозге различных видов животных. Метод исследования включал создание детальной клеточной карты, где были выявлены короткие фрагменты ДНК, называемые энхансерами, которые выполняют роль переключателей для включения и выключения активности тех или иных генов именно в нужных клетках.
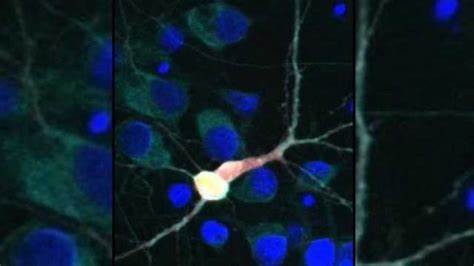
Энхансеры нашли применение в качестве своеобразных адресных меток, которые, вставленные в безопасные вирусные векторы, позволили исследователям доставлять генетический материал прямо в нужные нейроны. Простыми словами, учёные создали биологическую «почтовую службу», которая точно доставляет груз – будь то метка, подсвечивающая клетки, или потенциальное лекарственное средство – именно в моторные нейроны. Вирусы в данном случае используются как «грузовики-доставщики», не вызывая при этом никакого вреда организму. Проверка эффективности системы проводилась с использованием специального флуоресцентного белка, который светится под микроскопом и позволяет убедиться, что именно двигательные нейроны были помечены, а другие клетки остались нетронутыми. Благодаря такой адресной точности можно надеяться, что будущие методы лечения не будут затрагивать здоровые клетки, минимизируя риск побочных эффектов.
Практическое значение открытия трудно переоценить. В краткосрочной перспективе новая генетическая методика позволит исследователям более глубоко понимать механизмы развития БАС на уровне конкретных клеток и тканей. Возможность наблюдать за жизненным циклом и процессами гибели моторных нейронов в живых моделях заболевания поможет выявлять новые фармакологические мишени и диагностические маркеры, которые будут сигнализировать о скорости прогрессирования болезни. Это крайне важно для своевременного и точного подбора терапии. В долгосрочной же перспективе та же система генетического целенаправленного воздействия сможет стать средством для доставки генных или других биологических терапий непосредственно внутрь поражённых нейронов.
Такой подход способен радикально изменить стратегию лечения, предлагая целенаправленную защиту уязвимых клеток и, возможно, предотвращая их гибель. Кроме того, индивидуализация терапии – ещё одно перспективное направление, открывающееся благодаря возможности изучать разные подтипы моторных нейронов и особенности прогрессирования заболевания у различных пациентов. Отметим, что новейшая система была успешно протестирована на нескольких видах животных, что значительно повышает вероятность её эффективности и безопасности у человека. Уникальная возможность комбинировать несколько энхансеров позволяет одновременно воздействовать как на мотонейроны головного мозга, так и на спинномозговые – обе популяции, поражаемые при БАС. Разработка новой технологии стала результатом многолетней работы, сочетающей молекулярную биологию, нейронауку и современные инструменты генной инженерии.
Важнейшим аспектом является то, что теперь у исследователей появился «ключ» к самым недоступным и критически важным клеткам в патологии БАС. Эксперты считают, что такие прорывы не только приблизят нас к созданию эффективных методов лечения, но и повысят понимание работы нервной системы в целом. Многообразие нейронов и их сложные взаимодействия остаются важнейшим вызовом для науки. Тем не менее, новые технологии генетического таргетирования открывают путь к детальному изучению всех аспектов функционирования и патологии клеток мозга и спинного мозга. Уже сегодня команда Института Аллена активно ищет сотрудничество с фармацевтическими и биотехнологическими компаниями, чтобы перевести полученные результаты из лабораторий в клинические испытания и приблизить появление новых препаратов для пациентов с БАС всего через несколько лет.
«Среднее время на разработку лекарств составляет около 15 лет, поэтому такие ускоренные темпы – это настоящий прорыв», – отмечает ведущий исследователь проекта доктор Таня Дайгл. Для миллионов людей, больных БАС, и их близких, данное открытие приносит долгожданную надежду. Оно символизирует начало новой эры в изучении и борьбе с этим тяжелым заболеванием, где точность и индивидуальный подход становятся ключевыми факторами успеха. Именно такие достижения превращают фундаментальные научные исследования в реальные возможности изменить жизнь миллионов людей к лучшему. В заключение стоит подчеркнуть, что развитие современных генетических методов является одним из наиболее перспективных направлений в медицине будущего.
Целенаправленное воздействие на клетки, лежащие в основе тяжелых заболеваний, позволит не только разрабатывать эффективные препараты, но и значительно повысить качество жизни пациентов. Работа учёных из Института Аллена стала важнейшим шагом на этом пути и служит вдохновением для всего научного сообщества и общества в целом.